近期,J. Am. Chem. Soc.上发表了一篇文章:Conserved Enzymatic Cascade for Bacterial Azoxy Biosynthesis,通讯作者是浙江大学杜艺岭研究员和中科院深圳先进技术研究院周佳海研究员,其研究方向分别为:微生物天然产物的生物合成,致力于研究N-N键的生物合成过程以及酶的结构和功能研究。
含有氮-氮(N-N)键的化合物往往具有多样的生物活性和独特的分子结构(图1a)。这些N-N基团不仅在大量合成药物中作为重要的药效团,而且还是数百种生物活性天然产物不可或缺的结构成分。目前已经有文献报道催化N-N键形成的酶。尽管已经从植物微生物中分离得到多种含有氧化偶氮基的天然产物,但催化氧化偶氮基合成的酶学机制仍然尚不可知。
氧化偶氮基天然产物的早期生物合成研究对目前的研究提供大量借鉴意义。例如valanimycin的生物合成,经过几十年的研究,从化合物2到3的合成过程依然是未知的(图1c)。在先前研究的基础上,本文鉴定了两种金属酶协同作用催化氧化偶氮基的形成,阐明了valanimycin的完整生物合成过程。通过基因组挖掘和从其他氧化偶氮代谢产物的BGCs中同源酶的表征,表明这种双酶级联反应可能是细菌中广泛使用的合成氧化偶氮机制。
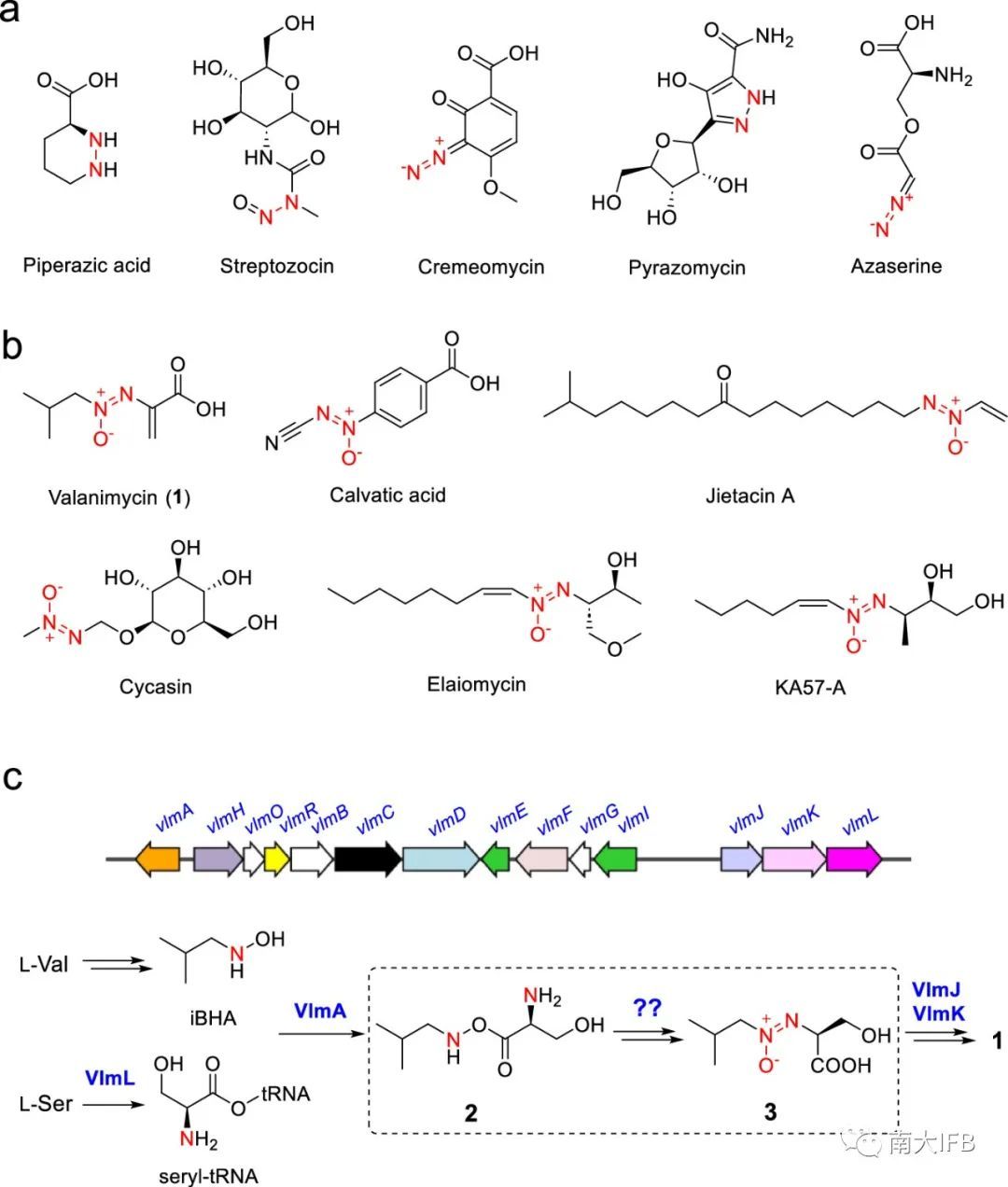
图1
在前人的研究基础上,目前仅有三个注释为未知蛋白的VlmO、VlmB和VlmG未表征功能。作者通过在大肠杆菌中共表达发现只有VlmO可以催化底物2生成偶氮化合物4(图2b)。进一步通过链霉菌异源表达、基因敲除以及体外酶反应等实验证实VlmO的功能。此外通过金属偏好性实验确定VlmO是铁依赖性催化偶氮的膜蛋白(图2c-f)。
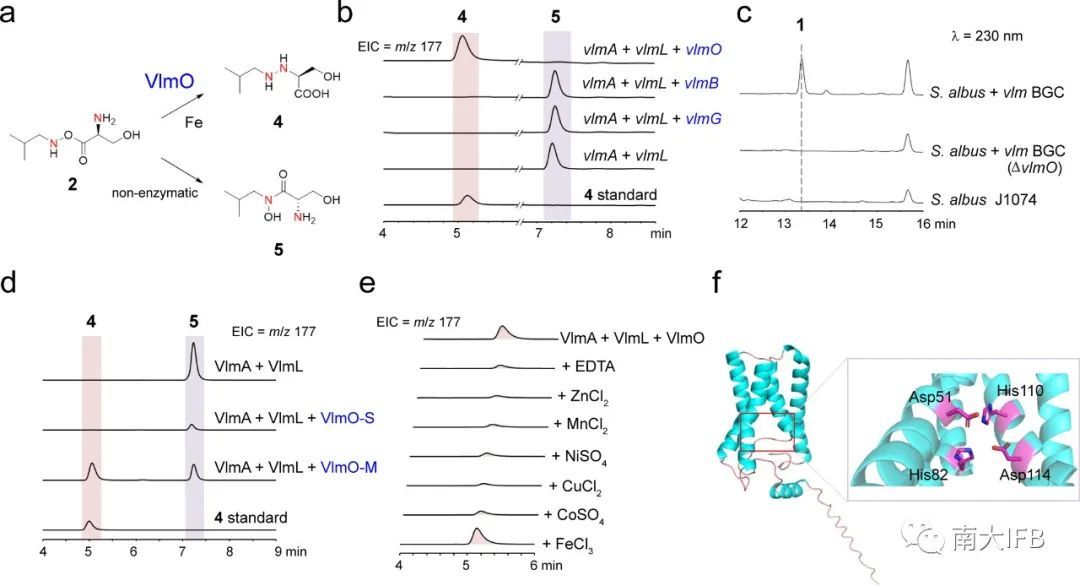
图2
接下来,作者分别将vlmB和vlmG在大肠杆菌体内共表达,发现VlmB可以识别底物4催化生成氧化偶氮化合物3(图3b)。随后作者通过在链霉菌中异源表达、体外酶反应、吸收光谱以及同位素标记等实验证实VlmB作为一种非血红素二铁氧化偶氮合酶,催化4与O2反应生成3(图3c-f)。
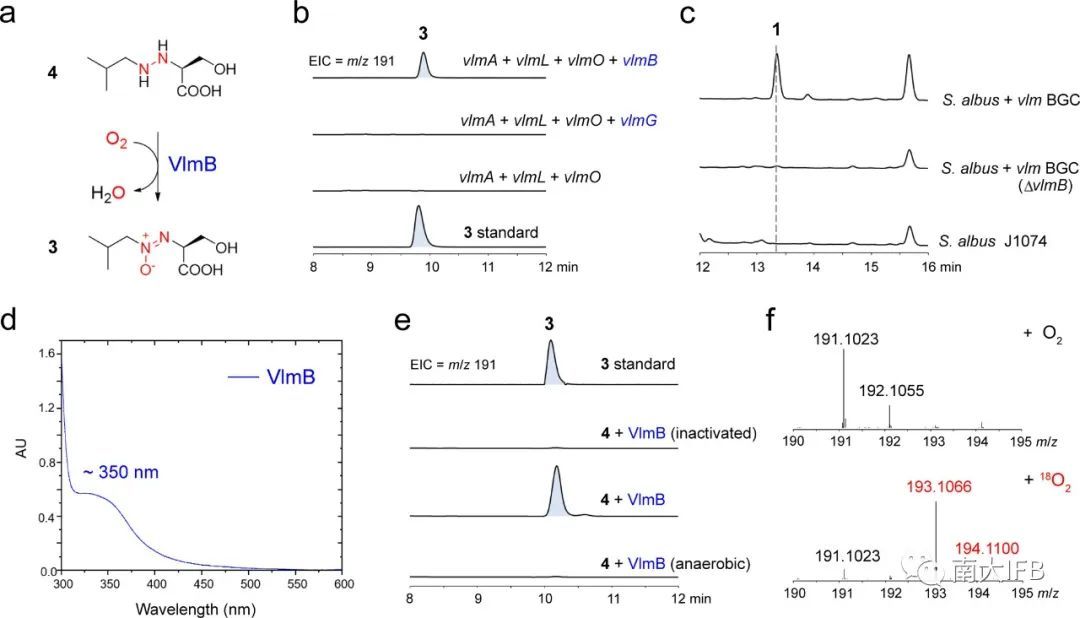
图3
为了深入探索VlmB的功能和催化机制,作者选取VlmB的同源酶VlmB-Ks与含N-N键的底物培养共晶,通过晶体结构可以发现二铁中心位于四个螺旋内,与四个谷氨酸和两个组氨酸配位,底物的羧基与Arg80相互作用(图4c、d)。通过对周边氨基酸进行点突变实验,发现Arg80和铁配位残基在VlmB催化氧化偶氮基形成中的关键作用(图4e、f)。此外作者还通过UV-vis光谱学和厌氧实验证实了底物4可以提供电子还原三价铁变为二价铁,自身被氧化成氮氮双键,随后在氧气的作用下生成氧化偶氮化合物3(图4a、b)。
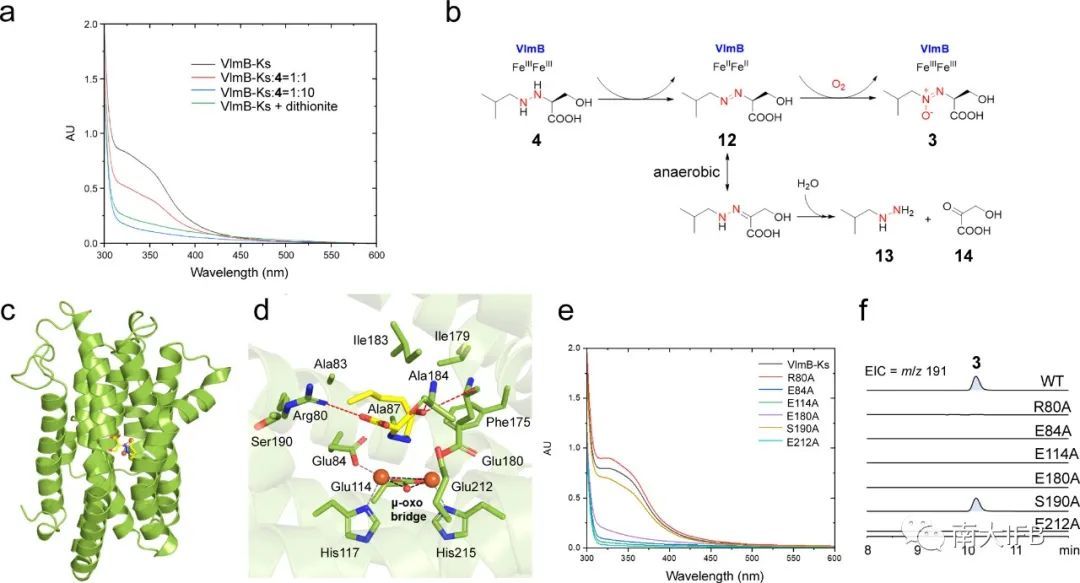
图4
最后作者通过分析化合物Elaiomycin和KA57-A的基因簇,找到VlmO/ VlmB的同源基因在该基因簇中保守存在,通过实验验证可以催化氧化偶氮基的形成(图5)。将金属酶的发现拓展到所有细菌氧化偶氮基的保守酶促途径。
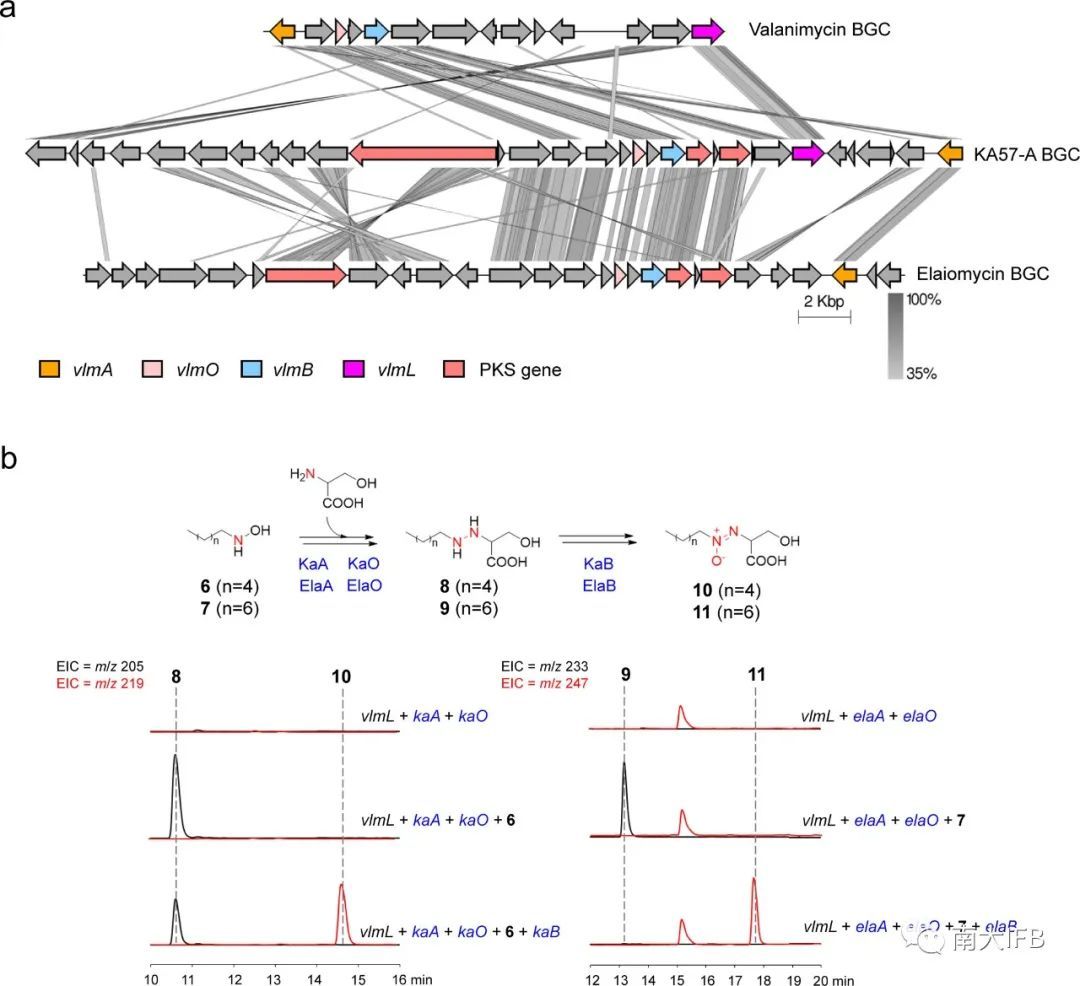
图5
本文以valanimycin的生物合成为例,从中鉴定了两个新颖的金属酶VlmO/VlmB,通过多种生化手段以及蛋白晶体对其酶学机制进行研究,最终发现VlmO/VlmB可以催化氧化偶氮基的形成。阐明了valanimycin的完整生物合成过程。通过基因挖掘的方法,揭示了两类金属酶在其他含有氧化偶氮基化合物的基因簇中保守存在且具有相应的催化功能,以此将valanimycin的生物合成研究升华到氧化偶氮基的生物合成研究。本研究有助于新的含氧化偶氮基的靶向分离和催化氧化偶氮基形成的生物催化剂的开发。
(本文转自南大IFB)

